Hukum Termodinamika (I, II dan III)
A. Hukum Termodinamika I
Bila kita berikan
sejumlah panas kecil sebesar dQ pada suatu sistem, maka sistem maka sistem
tersebut akan berekspansi melakukan suatu kerja luar yang kecil sebesar dW. Di
samping itu, pemanasan terhadap sistem juga akan menimbulkan hal-hal :
1. Pertambahan kecepatan molekul
dari sistem
2. Pertambahan jarak antar
molekul karena sistem berekspansi
Sehingga panas dQ yang
diberikan akan menyebabkan terjadi :
1. Pertambahan energi ke dalam
sistem
2. Pertambahan energi kinematik
molekul
3. Pertambahan energi potensial
4. Pertambahan energi fluida
Persamaan energi hukum
termodinamika I
dQ = dU + dEK +
dEP + dEF + dW
Bila pada sistem mengalami EK, EP dan EF konstan (dEK = 0,
dEP = 0, dEF = 0) maka disebut sistem diisolasi sehingga hukum termodinamika I
:
dQ = dU + dW
B. Hukum Termodinamika II
Hukum termodinamika II
merupakan batasan-batasan tentang arah yang dijalani suatu proses dan
memberikan kriteria apakah proses itu reversibel atau irreversibel. Salah satu
akibat dari hukum termodinamika II adalah konsep entropi. Perubahan entropi
menentukan arah yang dijalani suatu proses untuk melakukan perpindahan kerja W
dari suatu sistem pada kalor. Maka kalor yang harus diberikan kepada suatu
sistem selalu lebih besar.
Qdiserap > W yang
dihasilkan
ηsiklus<
100%
C. Hukum Termodinamika III
Hukum termodinamika III
terikat dengan temperatur nol absolut. Semua proses akan berhenti dan entropi
sistem akan mendekati nilai minimum. Hukum ini juga merupakan bukti bahwa
entropi benda berstruktur kristal sempurna pada temperatur nol absolut bernilai
nol.
D. Proses-proses pada hukum
termodinamika
a. Hukum Termodinamika I
- Isobarik
Pada proses ini
gas dipanaskan dengan tekanan tetap
Dengan demikian
pada proses ini berlaku persamaan Boyle-Gay Lussac
Jika
digambar dalam grafik hubungan P dan V adalah :
ΔW = ΔQ - ΔU = m.(Cp – Cv).(T2-T1)
-
Isokhorik/isovolumetrik
Pada
proses ini volume pada sistem konstan
Dengan
demikian pada proses ini berlaku hukum Boyle-Gay Lussac
Dalam
grafik hubungan P dan V didapat sebagai berikut :
ΔV = 0 » W = 0 (tidak ada
usaha luas selama prose)
ΔQ = U2.U1
» ΔQ = ΔU » ΔU = m.Cv.(T1-T2)
- Isotermik
Selama
proses suhunya konstan
Maka
persamaannya menjadi :
P1.V1
= P2.V2
Dalam
grafik hubungan P dan V didapat sebagai berikut :
Persamaan
:
Ln x = 2,303 log x
- Adiabatik
Selama
proses tidak ada panas yang keluar/masuk sistem jadi Q = 0
Tidak
adanya panas yang keluar/masuk sistem maka berlaku hukum Boyle-Gay Lussac
Jika digambar pada grafik P
dan V maka didapat sebagai berikut
ΔQ = 0 » 0 = ΔU + ΔW
V2.V1 =
-ΔW
T1.V1γ-1
= T2.V2γ-1
b Hukum Termodinamika II
Menurut
Carnot, untuk efisiensi mesin Carnot berlaku pada
Dimana
:
T = suhu
η = efisiensi
P = tekanan
V = volume
W = usaha


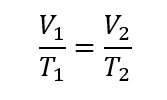



















0 komentar:
Post a Comment